细数日本免疫疗法之免疫检查点抑制剂的临床使用
癌症治疗中的免疫检查点的发现不但让科学家囊获诺贝尔医学生理学奖,还因其作用机理新颖、对部分患者疗效高、价格昂贵等备受医疗界瞩目。癌症免疫治疗领域目前全世界主要有5个阵营正在加速开发该类药品:日本小野药品工业联合美国施贵宝、美国默沙东公司、英国阿斯利康、瑞士罗氏制药、德国默克辉瑞。
免疫检查点抑制剂的作用机理与传统抗癌药物不同,可以期待其对多种恶性肿瘤的效果,我们整理了其在日本国内最新开发和临床使用的情况。
主要目录
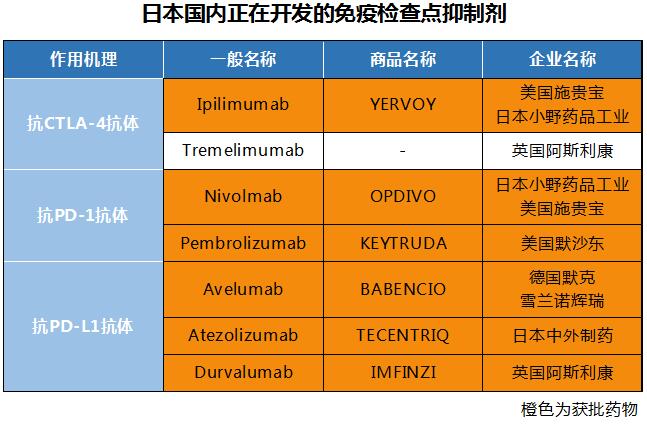
Ø 全世界正在开发的CTLA-4、PD-1、PD-L1相关7种药物
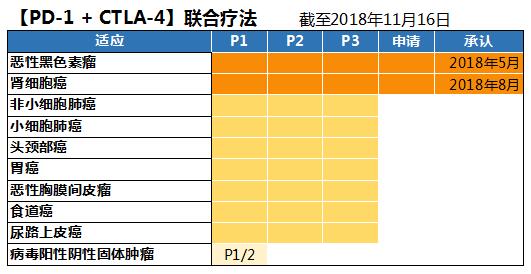
Ø 【PD-1/CTLA-4】 联合疗法获批用于黑色素瘤和肾细胞癌
Ø 【美国默沙东Keytruda】正在申请肺癌联合化疗无论是否表达PD-L1
Ø 【德国默克辉瑞】 “BABENCIO”获批用于默克尔细胞癌
Ø 【瑞士罗氏/日本中外制药】 正在申请肺癌一线治疗
Ø 【阿斯利康】 IMFINZI获批用于Stage3非小细胞肺癌
全世界正在开发的CTLA-4、PD-1、PD-L1相关7种药物
目前,在日本国内正在开发的免疫检查点抑制剂共有3个种类▽抗CTLA-4抗体▽抗PD-1抗体▽抗PD-L1抗体。在肿瘤免疫方面还有相关的活化免疫细胞分子抗体药物正在临床试验。
下图简单勾画了各免疫检查点抑制剂的作用机理
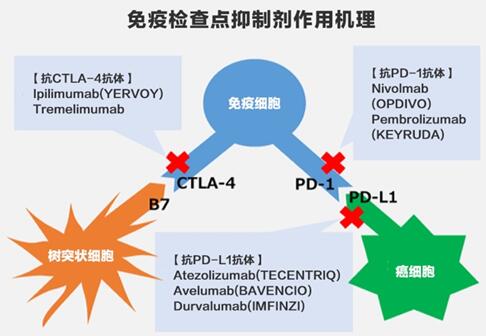
抗CTLA-4抗体是将免疫细胞表面的CTLA-4蛋白质作为标识(目标)的抗体药物。
免疫细胞在抗原递呈细胞树突状细胞的抗原提示下被激活,将抗原作为特定标识来攻击癌细胞。但是在抗原递呈过程中当免疫细胞的CTLA-4与树突状细胞的B7蛋白质结合时,免疫细胞的活性反被抑制,从而停止攻击癌细胞。
抗CTLA-4抗体可以防止CTLA-4与B7结合。施贵宝的伊匹单抗(YERVOY)就是这类药物。与此类似,抗PD-1抗体与抗PD-L1抗体是一对关联药物。
癌细胞为了从免疫细胞的攻击中逃逸, 自己生成PD-L1蛋白质,其与免疫细胞的PD-1结合后,就会抑制免疫细胞发挥作用。抗PD-1抗体与免疫细胞的PD-1蛋白结合后,能阻挡癌细胞的PD-L1与免疫细胞的PD-1结合。
小野药品工业/美国施贵宝的OPDIVO和美国默沙东的KEYTRUDA,这2种药物是抗PD-1抗体。德国默克/美国辉瑞的BAVENCIO、瑞士罗氏/日本中外制药的TECENTRIQ、以及英国阿斯利康的IMFINZI,这3种药物是抗PD-L1抗体。
【PD-1/CTLA-4】 联合疗法获批治疗黑色素瘤和肾细胞癌
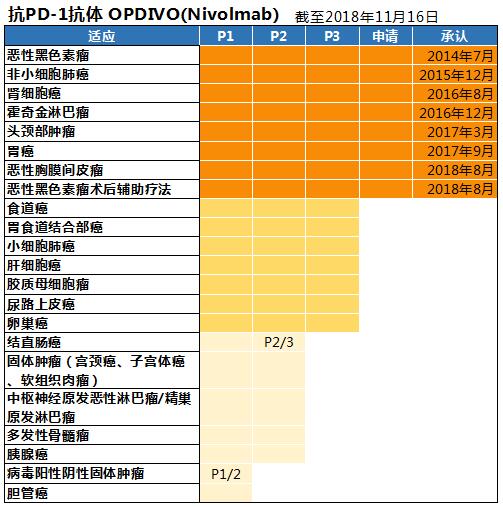
日本小野药品工业与美国施贵宝在肿瘤免疫领域有着广泛的合作。2014年9月小野药品在世界首发OPDIVO(俗称O药),这是世界上第一个免疫检查点抑制剂,用于治疗黑色素瘤。次年8月施贵宝的YERVOY(伊匹单抗)上市,也用于治疗黑色素瘤。
截止目前,OPDIVO已被批准治疗非小细胞肺癌(15年12月)、肾细胞癌(16年8月)、经典型霍奇金淋巴瘤(16年12月)、头颈部肿瘤(17年4月)、胃癌(三线、17年9月)。2018年8月又被批准治疗恶性胸膜间皮瘤和恶性黑色素瘤的术后辅助疗法。
日本已经批准OPDIVO的用量可改为1次240mg2周间隔,使用方法简便,同时减少病人未使用残药的经济负担。之前用量为1次3mg/kg(体重)。另外OPDIVO正在开展食道癌等7个肿瘤的第3期临床试验。
OPDIVO与YERVOY联合疗法于2018年5月被批准用于恶性黑色素瘤,2018年8月批准治疗肾细胞癌。此外,用于非小细胞肺癌的治疗正在开展5个第3期临床试验。
【美国默沙东 KEYTRUDA】正在申请肺癌联合化疗 无论是否表达PD-L1
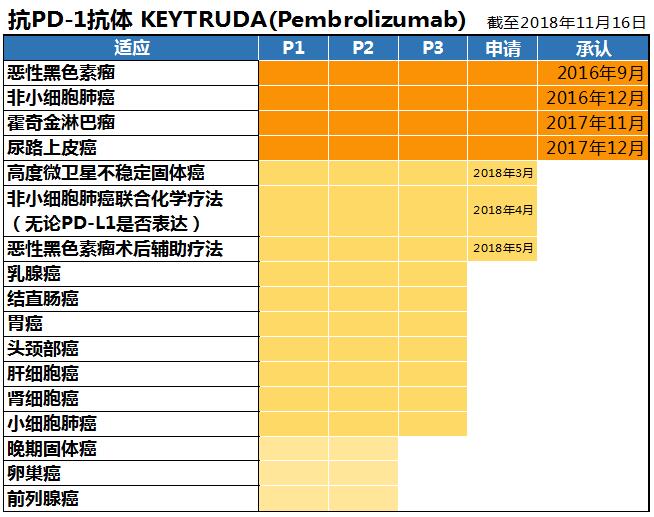
美国默沙东(日本法人MSD)正在开发抗PD-1抗体KEYTRUDA。16年9月批准用于恶性黑色素瘤,16年12月批准用于PD-L1表达阳性的非小细胞肺癌。因Opivibo药物价格的争论,KEYTRUDA推迟发布,于2017年2月上市销售。
针对其他癌症的使用,经典型霍奇金淋巴瘤(17年11月)和尿路上皮癌(17年12月)已经获得承认。为了扩大了适应范围,18年3月开始申请“局部晚期或者转移性高度微卫星不稳定肿瘤”。目前日本国内还没有不分癌种的以共同生物标志物为适应症的肿瘤药物,如果该申请获得批准,将是日本首例。
【德国默克辉瑞】 BABENCIO获批用于默克尔细胞癌
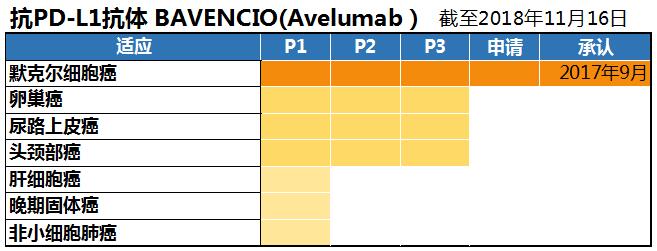
2014年默克与辉瑞在肿瘤免疫领域建立合作关系。由德国默克研发,两个制药公司共通开发的抗PD-L1抗体BABENCIO,于2017年9月获得批准治疗默克尔细胞癌。这是日本国内首个抗PD-L1抗体药物。默克尔细胞癌是发生于神经末端皮肤表层的罕见癌症,多发生在头颈部、手腕等阳光直射的部位。日本全国的患者人数不足100人。
为了扩大适应症范围,该药正在对尿路上皮癌、头颈部癌和卵巢癌进行第3期临床试验。治疗肝癌、非小细胞肺癌在第1期临床试验中。
【瑞士罗氏/日本中外制药】 正在申请肺癌一线治疗
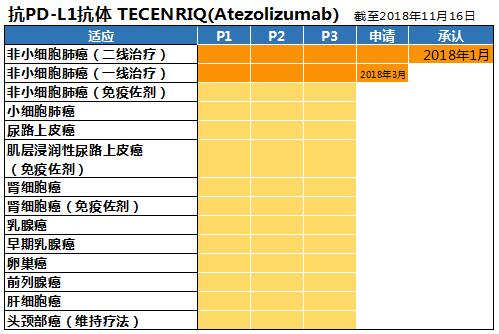
罗氏集团开发的抗PD-L1抗体药物叫做TECTNRIQ。日本国内的开发由其集团内的中外制药承担。2018年1月抗PD-L1抗体药物首次在日本国内获批用于治疗非小细胞肺癌。当年3月,该药与其他化疗药物联合使用,开始申请非小细胞肺癌的一线治疗。
现在正在进行第3期临床试验的有12种癌症,早期乳腺癌的试验已经开始。18年预计申请治疗乳腺癌和肾细胞癌。
【阿斯利康】 IMFINZI获批用于Stage3非小细胞肺癌
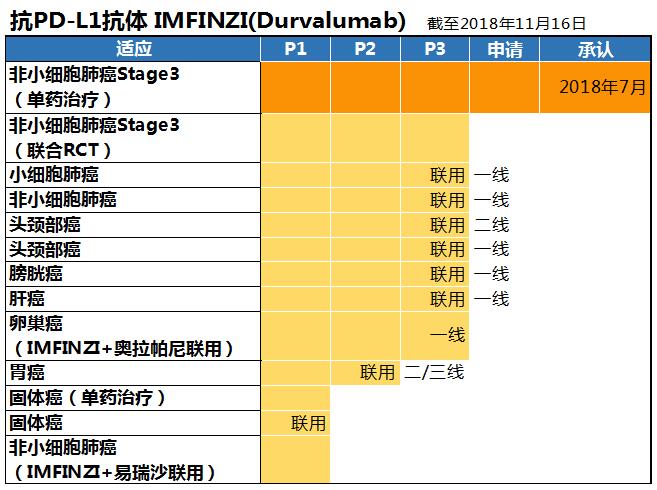
阿斯利康正在同时开发抗PD-L1抗体Durvalumab和抗CTLA-4抗体Tremelimumab。同时开发PD-1/PD-L1和CTLA-4的制药企业只有小野/施贵宝与阿斯利康两个阵营。阿斯利康是唯一一家同时在两个免疫检查点上同时开发药物的企业。
2018年8月 Durvalumab被命名为IMFINZI,获批称为不可手术的3期非小细胞肺癌用药。这是第一个Stage III非小细胞肺癌可以使用的免疫检查点抑制剂,为近些年一直停步不前的3期非小细胞肺癌治疗带来了新希望。
在开发阶段,12个肿瘤项目中Durvalumab(抗PD-L1)+Tremelimumab(抗CTLA-4)联合使用的项目占8个。IMFINZI联合化疗治疗3期非小细胞肺癌的临床试验已经开展到第3期,除此之外,联合奥拉帕尼治疗卵巢癌的临床试验也正在进行中。
-
相关内容
- 细数日本免疫疗法之免疫检查点抑制剂的临床使用
- 免疫治疗新药即将诞生:可同时激活T细胞和NK细胞
- 日本免疫治疗:基于变形菌基因组学的HLA提示新生抗原解析
- 关于有效新生抗原的选择
- 免疫疗法CAR-T在日本的最新进展
- 日本肺癌一线治疗方案:使用免疫检查点抑制剂联合化疗
- 与PD-1抗体结合的T细胞只有收到树突细胞的指令才能抗癌
- 癌症疫苗有望成为具有变革意义的个性化免疫疗法
- 日本濑田诊所后藤重则教授解答免疫疗法
- DC与NK细胞有助于PD-1免疫治疗的成功应答
- 边缘区B细胞可与树突状细胞一样作为抗原呈递细胞
- 科学家发现通过培养大量树突状细胞可以预防癌症复发
- 日本国立癌症中心使用免疫疗法预防肝细胞癌术后复发
- 日本专家开展对乳腺癌肿瘤微环境和PD-L1的表达的研究
- 日本专家开展对胃癌微环境与PD-L1、PD-L2抗体的研究
- 免疫疗法未来可以把人类细胞转化成为微型的抗肿瘤药物工厂
- 肺癌术前使用免疫疗法可有效预防复发
- 美国科学家不断完善T细胞的再生,努力实现免疫细胞治疗的突破

