溶瘤病毒联合PD-1抑制剂免疫治疗的效果
在战争中协同作战的精髓就在于不同的力量、在不同领域、围绕同一个目标,互补所长、互相配合、共同作战。不久前,美国加州大学洛杉矶分校Jonsson综合癌症中心Antoni Ribas所领导的一个国际团队,就将这种理念应用到了癌症的治疗上。

Antoni Ribas教授
研究人员先是向黑色素瘤局部注射溶瘤病毒,破坏肿瘤微环境,然后全身系统性静脉应用PD-1抑制剂,激活和增强T细胞对肿瘤细胞的攻击和杀伤。这就好比围剿敌方老巢时,先发射导弹进行战略轰炸,再派特种部队全面清剿。
这项由美国、瑞士、西班牙、澳大利亚四国科学家进行的晚期黑色素瘤患者Ib期临床试验,结果大大超出预期。联合使用溶瘤病毒和PD-1抑制剂治疗,患者黑色素瘤肿瘤中有82%出现50%以上的消退,肿瘤客观反应率较单药治疗效果提升55%以上,其安全性也得到了验证。研究结果发表在《Cell》杂志[1]。
黑色素瘤在中国的广为人知,得益于电影《非诚勿扰2》中李香山的“现身说法”。据《中国黑色素瘤诊治指南(2015)》显示,黑色素瘤是发病率增长最快的恶性肿瘤之一,年增长率为3%-5%[2]。在美国,黑色素瘤仍是发病率最高的癌症类型[3]。
早期黑色素瘤可以通过手术切除,取得不错的治疗效果。但是由于黑色素瘤易转移,预后差,对放化疗都不敏感,尤其是已发生转移的晚期恶性黑色素瘤,中位生存期只有7.5个月,5年生存率不足5%[2]。
为了对抗这一“劲敌”,FDA曾批准了一系列用于治疗的药物,2015年,溶瘤病毒成为第一种被批准的利用转基因病毒对抗癌症的治疗药物。然而这样一个“以毒攻毒”的疗法,虽然听起来振奋人心,实际的抗癌效果并不理想。应用溶瘤病毒治疗,患者肿瘤客观反应率仅为26.4%(包括原肿瘤和新发肿瘤在内所有肿瘤负荷减少50%并维持4周以上,为肿瘤客观反应)[4]。
尽管溶瘤病毒本身的治疗效果没有预想中那么神奇,但是基于溶瘤病毒能够在一定程度上瓦解肿瘤微环境,并且细胞裂解产物会吸引大量的CD8+T细胞(杀伤性T细胞)聚集,那么在溶瘤病毒之后紧接着应用免疫治疗药物,是不是就能避免免疫治疗中的免疫抑制,发动T细胞对肿瘤细胞的大规模攻击,从而发挥“双重”抗癌功效呢?
研究者在实验中选择了PD-1(程序性死亡受体-1)抑制剂。肿瘤细胞表达的PD-L1受体,与T细胞表面的PD-1结合,使T细胞以为肿瘤细胞是“自家人”,从而躲避免疫攻击。PD-1抑制剂则能够阻断PD-1与PD-L1的结合,从而恢复T细胞对肿瘤细胞的攻击。但是如果肿瘤微环境中本身就缺少T细胞的存在,PD-1抑制剂的抗癌作用可能就大打折扣了,以往的报道证实了这一点,也许正因如此,PD-1抑制剂治疗黑素瘤患者的客观反应率仅为35%-40%。[5,6]
为了验证“联合作战”的猜想,研究人员招募了21名IIIB-IV期、已不能手术切除的晚期皮肤黑色素瘤患者。这些患者均至少有一个皮肤黑色素瘤病损直径大于10mm,且有一个以上直径大于10mm的皮肤、皮下或结节肿瘤可用于瘤内注射。
一开始,研究人员采用瘤内注射的方式,对患者进行溶瘤病毒治疗。6周后,开始静脉注射应用PD-1抑制剂。到第18周时,各期患者原发灶肿瘤及转移灶肿瘤均有消退反应。

实验中观察发现,肿瘤客观反应率达到62%,完全反应率为33%(肿瘤完全反应为所有肿瘤负荷消失并持续4周以上),对比单药治疗,肿瘤的客观反应率提升了55%以上。研究人员还专门观察了7名IIIB/IIIC期患者,16个注射溶瘤病毒的皮肤黑色素瘤肿瘤和10个未注射溶瘤病毒的皮肤黑色素瘤肿瘤,注射溶瘤病毒者93.7%出现缩小,未注射溶瘤病毒者60%出现缩小。
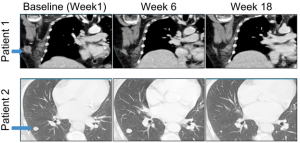
图示患者原发灶及转移灶肿瘤消退
为了确定两种药物联合应用背后的机制,研究者进行了免疫组化检查。与之前单独应用免疫疗法时结果不一致的是[5],实验中有9名患者实验开始时CD8+T细胞浓度偏低,3名患者开始时IFN-γ(肿瘤浸润时T细胞产生,并且诱导肿瘤细胞产生PD-L1)表达偏低,但是他们都表现出较好的肿瘤治疗反应。
事实上,在CD8+T细胞浓度高的情况下,阻断肿瘤细胞与T细胞间PD-1/PD-L1通路的PD-1抑制剂更容易施展其抗癌作用,相反CD8+T细胞浓度低的情况下PD-1抑制剂可能无用武之地,那么,实验中PD-1抑制剂的“逆袭”是不是溶瘤病毒起了作用呢?
研究这12名患者的组织切片发现,使用溶瘤病毒单药治疗后,这12名表现反常的患者中有8名在注射溶瘤病毒后出现CD8+T细胞浓度升高,3名CD8+T细胞浓度不变,1名CD8+T细胞浓度下降。证实了溶瘤病毒注射增加了肿瘤微环境中CD8+T细胞浓度,为PD-1抑制剂起作用创造了条件。
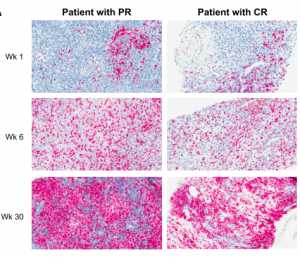
图中红色染色为CD8+T细胞
同时研究中应用基因表达分析显示,单药治疗后CD8α和IFN-γmRNA上升,免疫荧光检查和血液检查中发现实验过程中肿瘤微环境中其他免疫细胞的增加。
在安全性方面,试验结果也是可喜的,此次试验中除出现两种药物单独治疗时存在的不良反应外,联合治疗过程中21位受试者均未出现新的药物不良反应。
研究者认为,这个Ib期临床试验虽然规模不大,却是第一个取得极高的肿瘤总体缓解率和完全缓解率的免疫疗法联合应用的人体实验。研究人员表示,目前人数为660人的III期临床实验已在开展过程中。
看来对于“奸诈狡猾”的肿瘤,除了寄托于医疗科技的进步,科学家们也要不断创新治疗策略。
参考资料:
1. Ribas A, Dummer R, Puzanov I, et al. Oncolytic Virotherapy Promotes Intratumoral T Cell Infiltration and Improves Anti-PD-1 Immunotherapy[J]. Cell, 2017, 170(6): 1109-1119. e10.
2. 《中国黑色素瘤诊治指南:2015版》,CSCO黑色素瘤专家委员会编著.北京:人民卫生出版社,2015.ISBN 978-7-117-21339-4.
3.https://www.cancer.org/cancer/melanoma-skin-cancer/about/key-statistics.html
4. Andtbacka et al, Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. DOI: 10.1200/JCO.2014.58.3377 Journal of Clinical Oncology 33, no. 25 (September 2015) 2780-2788.
5. Tumeh et al, PD-1 blockade induces responses by inhibiting adaptive immune resistance.Nature 515,568–571(27 November 2014)doi:10.1038/nature13954
6.Ribas et al. Association of pembrolizumab with tumor response and survival among patients with advanced melanoma. JAMA 315, (2016)1600–1609.
-
相关内容
- 溶瘤病毒联合PD-1抑制剂免疫治疗的效果
- 联合使用PD-L1和NKG2A单抗,可清除75%的肿瘤组织
- 新生抗原成为免疫治疗新焦点
- 粪便移植成功“治愈”免疫疗法副作用
- 细数日本免疫疗法之免疫检查点抑制剂的临床使用
- 免疫治疗新药即将诞生:可同时激活T细胞和NK细胞
- 日本免疫治疗:基于变形菌基因组学的HLA提示新生抗原解析
- 关于有效新生抗原的选择
- 免疫疗法CAR-T在日本的最新进展
- 日本肺癌一线治疗方案:使用免疫检查点抑制剂联合化疗
- 与PD-1抗体结合的T细胞只有收到树突细胞的指令才能抗癌
- 癌症疫苗有望成为具有变革意义的个性化免疫疗法
- 日本濑田诊所后藤重则教授解答免疫疗法
- DC与NK细胞有助于PD-1免疫治疗的成功应答
- 边缘区B细胞可与树突状细胞一样作为抗原呈递细胞
- 科学家发现通过培养大量树突状细胞可以预防癌症复发
- 日本国立癌症中心使用免疫疗法预防肝细胞癌术后复发
- 日本专家开展对乳腺癌肿瘤微环境和PD-L1的表达的研究

